أحرز علماء من جامعة كاليفورنيا في سانتا باربرا تقدماً كبيراً نحو وقف النمو المتواصل للأكياس التي تميّز مرض الكلى المتعدد الكيسات (PKD)، وهو أحد أكثر الاضطرابات الوراثية شيوعاً التي تؤدي تدريجياً إلى فشل الكلى.
مرض الكلى المتعدد الكيسات: حالة وراثية بلا علاج حتى الآن
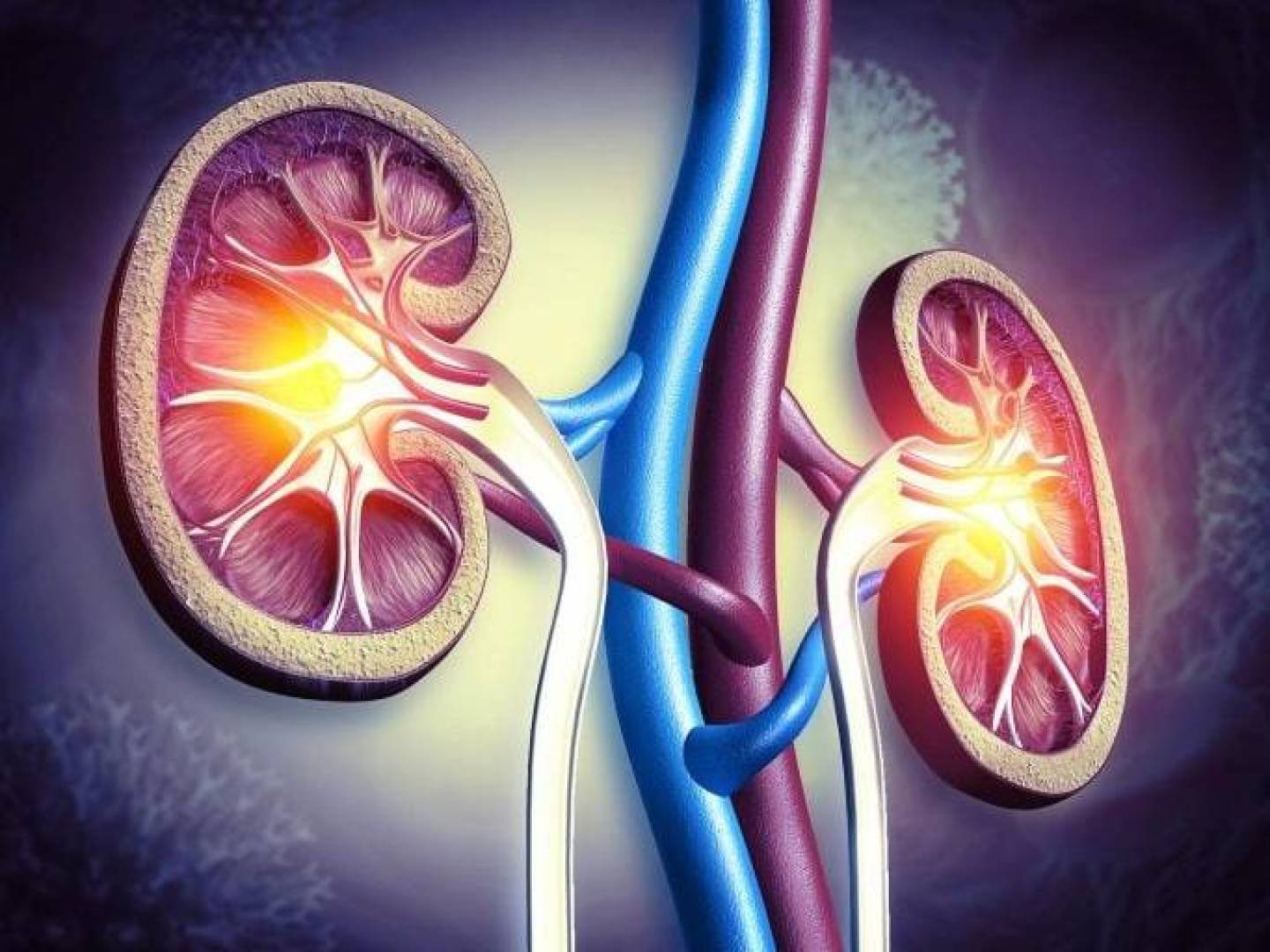
يُعد مرض PKD حالة وراثية تتكون فيها مجموعات من الأكياس المملوءة بالسوائل داخل الكلى، وتكبر هذه الأكياس تدريجياً وتتكاثر، مما يعيق عمل الكليتين ويسبب آلاماً شديدة، ومع الوقت قد يصل الكثير من المرضى إلى مرحلة تتطلب غسيل الكلى بسبب العجز الكلوي، وحتى اليوم لا يوجد علاج قادر على إيقاف المرض جذرياً.
ويعمل الباحثون حالياً على تطوير علاج يستهدف الأكياس مباشرة من الداخل، وذلك عبر أجسام مضادة أحادية النسيلة، وهي بروتينات مصممة مخبرياً تستخدم في العديد من تقنيات العلاج المناعي.
وقال عالم الأحياء توماس ويمبس، المؤلف الرئيسي للدراسة المنشورة في مجلة Cell Reports Medicine:
"هذه الأكياس تستمر في النمو بلا توقف ونريد إيقافها لذا نحتاج إلى إيصال دواء داخل هذه الأكياس يمنعها من الاستمرار."
كما أُجري هذا البحث بدعم من المعاهد الوطنية للصحة ووزارة الدفاع الأمريكية.
لماذا تفشل الأدوية الحالية؟
أظهرت بعض الأدوية الجزيئية الصغيرة القدرة على إبطاء نمو الأكياس، إلا أنّ الدواء الوحيد المتاح حالياً يسبب آثاراً جانبية كبيرة على أنسجة الكلى. وعلى الرغم من دقة استهداف الأجسام المضادة المخبرية، إلا أنّ النوع الأكثر استخداماً، وهو الغلوبولين المناعي G (IgG)، كبير جداً بحيث لا يستطيع اختراق الأكياس حيث تنشأ المشكلة.
ويشرح ويمبس قائلاً:
"أجسام IgG فعّالة جداً في علاج السرطان، لكنها لا تستطيع عبور طبقة الخلايا، وبالتالي لا تصل أبداً إلى داخل الأكياس."
ويُعد داخل الكيس وهو تجويف مبطن بخلايا طلائية نقطة الانطلاق لعملية نمو الأكياس.
ويضيف:
"كثير من الخلايا المبطنة للكيس تنتج عوامل نمو تُفرز داخل السائل الموجود داخل الكيس، ثم ترتبط مجدداً بالخلايا نفسها أو بالخلايا المجاورة. إنها حلقة مستمرة لا تنتهي من التحفيز المتبادل."
وخلص الفريق إلى أن حجب عوامل النمو أو مستقبلاتها يمكن أن يوقف هذه العملية المتواصلة.
جسم مضاد جديد قادر على اختراق الأكياس
هنا ظهر دور الغلوبولين المناعي أ الثنائي (dIgA)، وهو جسم مضاد أحادي النسيلة قادر على عبور الأغشية الظهارية. ففي جسم الإنسان، يُفرز dIgA طبيعياً في المخاط واللعاب والدموع كخط دفاع أول ضد الميكروبات.
وسبق أن نشرت مجموعة ويمبس في عام 2015 ورقة بحثية تقترح أن dIgA يمكن أن يرتبط بمستقبلات معيّنة في الخلايا الظهارية، ويمر عبر الأغشية ليصل إلى داخل أكياس الكلى، حيث يمكن استهداف المستقبلات المرتبطة بنمو الأكياس غير المنضبط.
وتُظهر الدراسة الجديدة فعالية هذا الجسم المضاد في استهداف مستقبل cMET، أحد أهم المحركات لنمو الأكياس.
الهندسة الحيوية للجسم المضاد واختباره
بدأ الباحثون بتعديل الحمض النووي الخاص بالغلوبولين المناعي IgG لإعطائه "هيكلاً جديداً"، محولينه بذلك إلى جسم مضاد من نوع dIgA. وبعد التأكد من قدرته على التعرف على المستقبل المطلوب، جرى اختباره على نماذج فئران مصابة بالمرض.
وقد تمكن الجسم المضاد من الوصول إلى داخل الأكياس والبقاء فيها.
ثم طرح ويمبس السؤال الأهم:
"هل يستطيع فعلاً حجب مستقبل عامل النمو؟"
وأظهرت النتائج انخفاض نشاط مستقبل cMET وتراجع الإشارات المحفزة للنمو داخل خلايا بطانة الأكياس. كما سبّب العلاج بداية مفاجئة لعملية موت الخلايا (الاستماتة) في الخلايا المريضة داخل الأكياس فقط، دون الإضرار بالأنسجة الكلوية السليمة، ودون أي آثار جانبية ملحوظة.
خطوات مستقبلية نحو علاج PKD
يشير ويمبس إلى أن البحث ما يزال في مرحلة ما قبل السريرية، وسيستغرق وقتاً قبل التفكير في تطبيقه على البشر. ويحتاج الفريق إلى شركاء مهتمين بمرض PKD وإلى منشآت قادرة على تطوير أجسام مضادة جديدة واختبار أهداف إضافية.
ويضيف:
"هناك عشرات عوامل النمو التي ثبت نشاطها داخل أكياس الكلى في الأدبيات العلمية. لذلك سيكون من المفيد مقارنة حجب عدة عوامل نمو وعدة مستقبلات في الوقت نفسه لمعرفة الأكثر فعالية، ورؤية إن كان بإمكاننا تحقيق إبطاء أو حتى عكس تقدم المرض، ويمكن أيضاً الجمع بين أجسام مضادة مختلفة ضد مستقبلات متعددة."